治験管理センターのご案内(概要)
治験管理センターは、治験を円滑で適正に行うことができるように、治験に関わる業務を行う部門です。治験には医師、病院職員はじめ、それ以外にも多くのスタッフが関わっており、医療チ-ムとして活動しています。
問い合わせ先
| 所在地 | 〒590-0018 堺市堺区今池町3丁3番16号 公益財団法人 浅香山病院 治験管理センター |
|---|---|
| 対応時間 | 月曜日~金曜日 9:00~17:00 (祝祭日及び、年末年始を除く) |
| お問い合わせ | TEL 072-229-4882(代表) [内線:5236、3388] |
治験について
治験とは
治験とは
製薬会社が開発した新しいくすりを病院などの医療施設で使用するには、事前に国の承認をもらうことが法律で義務づけられています。そのためには承認される前の「くすりの候補」を、実際に医療施設で患者さまに投与することにより、安全性と有効性(効果)などを確かめる必要があります。この新薬開発のため、実際にヒトにくすりの候補を投与する試験のことを「治験」といいます。
治験はなぜ必要か
もしもヒトでの安全性を確かめないままに、新しいくすりが世の中に出て使用されたとしたら、予期しない副作用が発生して多くの人に被害をもたらしかねません。また、効果のないくすりであったなら、投与することにより患者さまは他の有効な治療を受ける機会を奪われることになり、また無駄な時間を費やすことになります。そうならないために、くすりが世に出る前に、有効性や安全性を慎重に確認する治験が必要となります。
治験のルール
治験に参加していただく方の権利や安全が守られるよう、また、くすりの候補の効き目や副作用が科学的な方法で調べられるよう、治験は国が定めた厳格なルールに従い実施されます。
治験のしくみ
くすりの誕生
くすりは多くの人々の生命や健康を支えてきました。しかし、今も充分な治療薬のないさまざまな病気があります。そのため、新しいくすりを開発する努力が世界中で続けられています。
くすりは、以下に示す多くのステップを踏んでから世の中に出て来ます。くすりの候補から実際にくすりとなるのはごくわずかで、約10~15年あまりの期間をかけてくすりとして認められます。
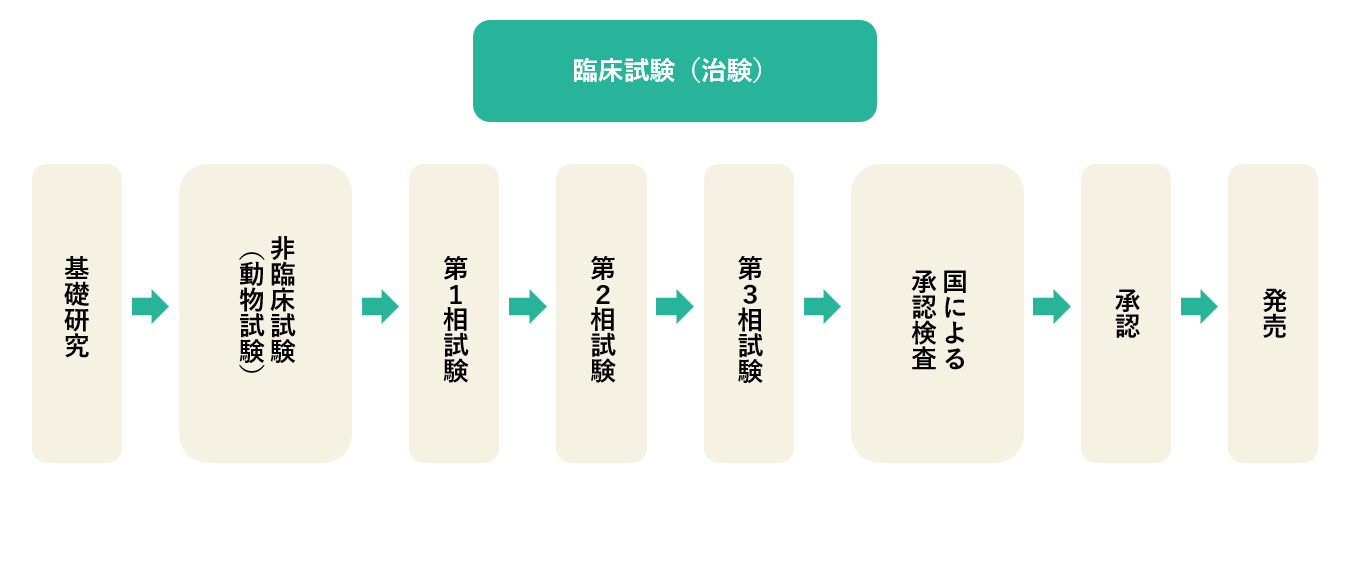
基礎研究
新しいくすりの開発は、製薬企業などの研究室で化学的に合成されたり、天然に存在している物質から抽出されたりした、何千という化合物から、目的とする作用を持ったいくつかの物質を選び出すところから始まります。
非臨床(動物)試験
次に、ネズミ、ウサギ、サルなどの動物を使って、効果(有効性)と毒性(安全性)をくわしく調べ、くすりになりそうだと見込まれるものだけが、くすりの候補として残ります。
臨床試験(治験)
最後に、くすりの候補がヒトでどのような効き目や副作用を示すかが調べられます。ヒトと動物では、それらの現れ方が違うからです。
また、日本人と外国人でもくすりの効果に違いがでることがあるため、外国ではなく日本での治験が必要となります。治験では第1相試験から第3相試験を行います。
| 第1相試験 | 少数の健康成人などを対象に、主に安全性や薬の吸収、排泄などについて調べる試験です。 |
|---|---|
| 第2相試験 | 比較的少数の患者さまを対象に有効性、適切な投与量と安全性などを調べる試験です。 |
| 第3相試験 | 多数の患者さまを対象に、すでに使用されているくすりなどと比較して有効性と安全性を比較する試験です。 |
治験への参加
患者さまの治験参加へのながれ
- 医師は治験参加の条件にあった患者さまに治験の参加を打診し、治験の内容を説明します。また、必要に応じてCRCがより詳しく治験の内容や治験のスケジュールなどを説明します。
- 患者さまは、治験の内容をよく理解した上で、参加するかどうかを自分の意思で決めます。参加に同意する場合は、同意書に署名をします。なお同意した後であっても、患者さまの意思でいつでも同意を取り消すことができます。
- 治験が始まると、患者さまには治験担当医師からの服薬指示を守っていただき、スケジュールに従って診察や検査を受けていただきます。治験担当医師は治験中、患者さまの状態を観察し、副作用などに注意を払います。なお、治験の参加にあたっては患者さまのプライバシーは守られ、サポート体制も整っています。また、治験期間中に実施される検査、来院時の交通費などの費用の一部は治験依頼者(製薬会社)が負担をします。
- スケジュールどおり期間が過ぎると治験は終了します。
患者さまに治験に協力していただくために
現在使用されているくすりも、患者さまの協力により誕生したものです。医師より、治験の参加の打診があった際には、さらに良いくすりを世に送り出すためにも、協力していただけると幸いです。治験について詳しく知りたい方は、治験管理センターのCRCにお申し出ください。
業務紹介
スタッフ
| センター長 | 髙橋 亮(副院長) |
|---|---|
| 事務局長 | 宮本 雅彦(副院長兼薬剤部長) |
| CRC責任者 | 筧 久仁子(薬剤部室長) |
当院の治験体制
治験には、医師の他にも多くのスタッフが関わります。当院では治験管理センターという部門を置き、チームとして活動しています。
- 「治験管理センター」とは治験に関する業務を適正かつ円滑に行うための部門をいいます。
- 「治験審査委員会」とは治験についての審議を行い、参加される患者さまの人権と安全性に問題がないかを審査する委員会です。委員会には審査の公正を期すために病院職員以外の方も審議に参加しています。
- 「治験責任医師」は治験の実施に関して責任を有する医師で、治験の中心となってその業務を適正に行なっていきます。
- 「治験分担医師」は治験責任医師に協力して治験を実施します。
- 「CRC:Clinical Research Coordinator」は臨床研究コーディネーターの略です。治験責任医師または治験分担医師の指示のもとで治験の実施に協力する専門のスタッフです。患者さま、治験依頼者(製薬会社)、医師の間に立って治験を円滑に進めていきます。
治験審査委員会(IRB:Institutional Review Board)
当院で行う治験は、治験審査委員会と呼ばれる委員会で、治験を実施することが倫理的、科学的及び医学的・薬学的に妥当かどうか検討し、その承認を得ています。また、治験について新しい重要な情報が得られた場合、治験担当医師の変更、その他変更事項が生じた場合は、治験を継続して良いかを検討し、治験が適切に実施されていることを確認する役割を担っています。
会議の記録の概要
治験審査委員会の記録の概要につきましては、治験依頼者(製薬会社)の機密情報保護の観点より、ホームページでの公表は実施しておりません。治験審査委員会開催後、2ヶ月を目処に治験管理センターにて一般の閲覧が可能です。閲覧を希望される方は、治験管理センターまでお問い合わせください。
治験依頼者(製薬会社)の方へ
治験依頼者(製薬会社)の方へ
治験開始までの流れ
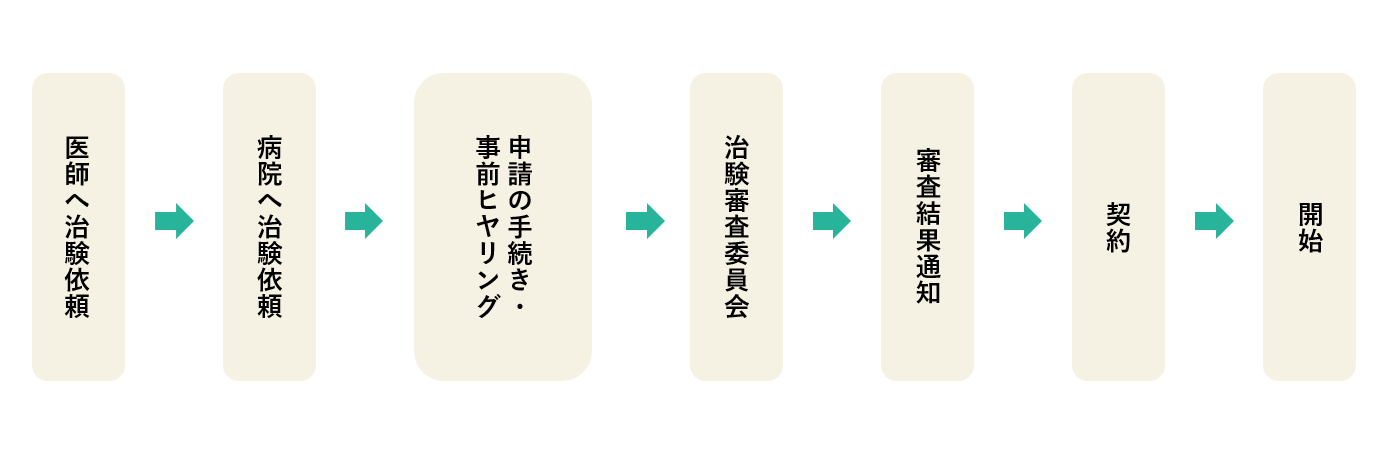
申請(治験)
当院に治験の実施を申し込む場合は、治験管理センターからの説明を受けた後、必要な書類を提出し、申請をしてください。
※治験審査委員会への申請書式は、厚生労働省の通知に基づく「治験の依頼等に係る統一書式」をご使用ください。
治験審査委員会は、2ヶ月に1回(奇数月の第3もしくは第4火曜日(祝祭日の際は別途調整催))開催しています。審査の希望、ご相談等は治験管理センターまでご連絡ください。